アルツハイマー病の分子病態
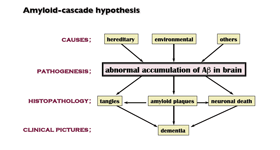
| アルツハイマー病の分子病態に関しては現在までアミロイド(Aβ)カスケード仮説が有力です。すなわち、Aβの脳内過剰蓄積が分子病態の根源であるとされています。本研究室では主に
神経細胞のAβ生成に対する分子制御メカニズムの解明とそれに基づいた治療法開発に焦点を当てたプロジェクトを進めています。
|
 |
(I)神経細胞のAβ生成を制御する分子メカニズムの解明
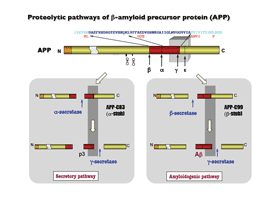
| 脳のAβは主に神経細胞によって作られます。Aβは前駆体タンパク質であるAPPがβセクレターゼとγセクレターゼにより切断されてできる40ないし42アミノ酸から成るポリペプチドです。
このうち、γセクレターゼはAPPの膜貫通領域を加水分解するという大きな特徴をもっています。膜内という疎水性環境においてタンパク質を加水分解するプロテアーゼがあることは近年になって明らかになってきた新しい知見です。このようなプロ
テアーゼによる切断が調節されるメカニズムをはじめ、細胞に本来備わっているAβ生成制御の分子機構を知ることから、副作用のないAβ生成抑制法の開発を目指します。 |
 |
(II)γセクレターゼの切断部位特異性を制御する細胞内因性メカニズムの解明
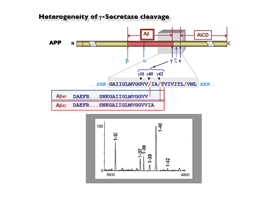
| Aβにはγセクレターゼ切断部位のずれによりアミノ酸鎖長の異なる分子種が知られ、約90%を占めるとAβ40と約10%にあたるAβ42などが検出されています。アルツ
ハイマー病の病態には脳内Aβ量とともにAβ42/ Aβ40比が重要であることが判明してきました。すなわち、病態を惹起するのはAβ42であり、Aβ40はむしろ病態の進行を抑制するとされます。従って、
γセクレターゼの切断部位特異性を決めるメカニズムを明らかにし、これを人為的にコントロールすることができれば理想的な治療法開発につながる可能性があります。神経細胞が本来もつ制御メカニズムの解明から治療法の開発を目指します。 |
 |
(III)プレセニリンの機能解析
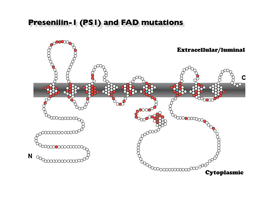
| 家族性アルツハイマー病の原因遺伝子であるプレセニリン(Presenilin-1 and Presenilin-2)は、膜タンパク質をコードし、多くの病原変異が知られています(右図参照。赤丸が病原変異の
知られる残基)。機能としてはγセクレターゼ複合体の構成タンパク質として触媒部位を提供することが知られると同時に、多機能タンパク質として、アポト-シスや細胞内Ca恒常性の維持、膜タンパク質輸送などに関与するとされています。多くの
機能をどのように使い分けるのか、多機能をもつことの生物学的な意義は何かなど興味ある問題です。 |
 |
(IV)孤発性アルツハイマー病の病因に関わる分子の同定
| アミロイド(Aβ)カスケード仮説において、Aβ蓄積の上流に位置する根本原因については遺伝子の変異や多型など先天的な要因が知られる以外はほとんど解明されていません。アルツハイマー病症例の
うち大半は遺伝的要因が推測できない孤発性の症例であることから、後天的要因の解明は臨床医学的に重要な課題です。つまり、その解明は多くの症例の発症を予防できるヒントにもなります。 |
(V)老化と神経変性のリスク
| 遺伝子に明らかな病原変異がある場合でも、多くは中高年になってアルツハイマー病を発症します。先天的変異による病態が臨床症状を出すに到るまでにそれだけの期間を要するのか、あるいは老化と
いう因子が加わることが発症に決定的に関わるのかは不明です。現在、生物学的な老化現象が分子レベルで解明され始めている背景から、この点を明らかにできる可能性がでてきました。 |