
Bre1aによる神経幹細胞の維持機構
神経幹細胞は、胎生期の脳で大量の神経細胞・グリア細胞を産み出すとともに、自分自身を維持するように、増殖と分化のバランスをうまくとる必要があります。増殖とは、すなわち細胞分裂(1個の細胞が分裂して2つの細胞になる過程を細胞周期と呼びます)の積み重ねであり、1回の細胞周期にかかる時間の調節が重要になってきます。神経幹細胞では、胎生期に細胞周期がどんどん伸びていき、成人の脳では遂に非常にゆっくりとしか分裂しなくなると考えられています。この”非常にゆっくりとしか分裂しない”という性質は、さまざまなタイプの幹細胞において、遺伝子変異のリスクを減らす(すなわち腫瘍化を防ぐ)という意義があるのだろうと、推測されています。
私たちは、神経幹細胞の細胞周期と分化のバ
ランスをとるために、両方を調節している因子
があるはずだと考え、Bre1aという遺伝子を同
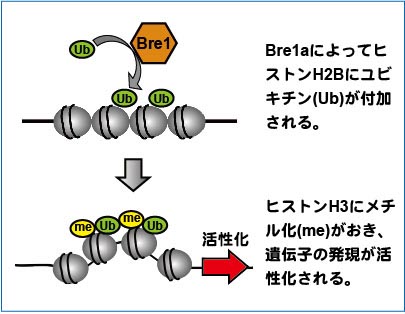
定しました。Bre1aは、細胞のDNAが巻き付い
ているヒストンと呼ばれるタンパク質の1つ、
H2Bをユビキチン化することが知られていまし
た(右図)。
最近、遺伝子の発現を調節する仕組みとして、
エピゲノム修飾という言葉がしばしば使われ、
世界中で研究のホットトピックスになっていま
す。Bre1aによるヒストンH2Bのユビキチン化
もエピゲノム修飾の1つで、細胞周期や分化に
関わる多くの遺伝子群の発現を制御しているものと考えられます。
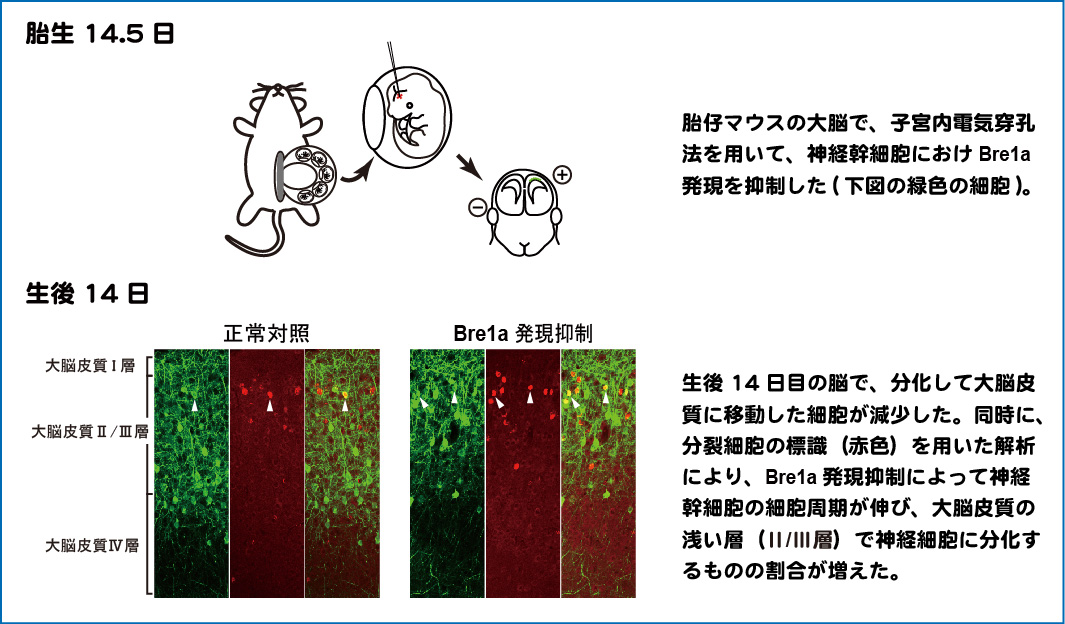
Bre1aは胎生期の脳の多くの細胞で発現していますが、神経前駆細胞のごく一部では発現低下しており、これらの細胞ではヒストンH2Bのユビキチン化も低下していました。そこで胎生期の神経幹細胞で人為的にBre1aの発現を低下させたところ、神経幹細胞の分化が抑制されることがわかりました。ここには、神経幹細胞の分化抑制に重要だと考えられている、Hes5の活性化が働いていることも、見出しました。同時に、Bre1aの発現が低下した神経幹細胞では、細胞周期が伸びて、分裂がゆっくりになっていることを、発見しました(下図)。
本研究は、アメリカ神経科学会誌 Journal of Neuroscience 2014年2月号に掲載されました。
この研究の意義と今後の展望
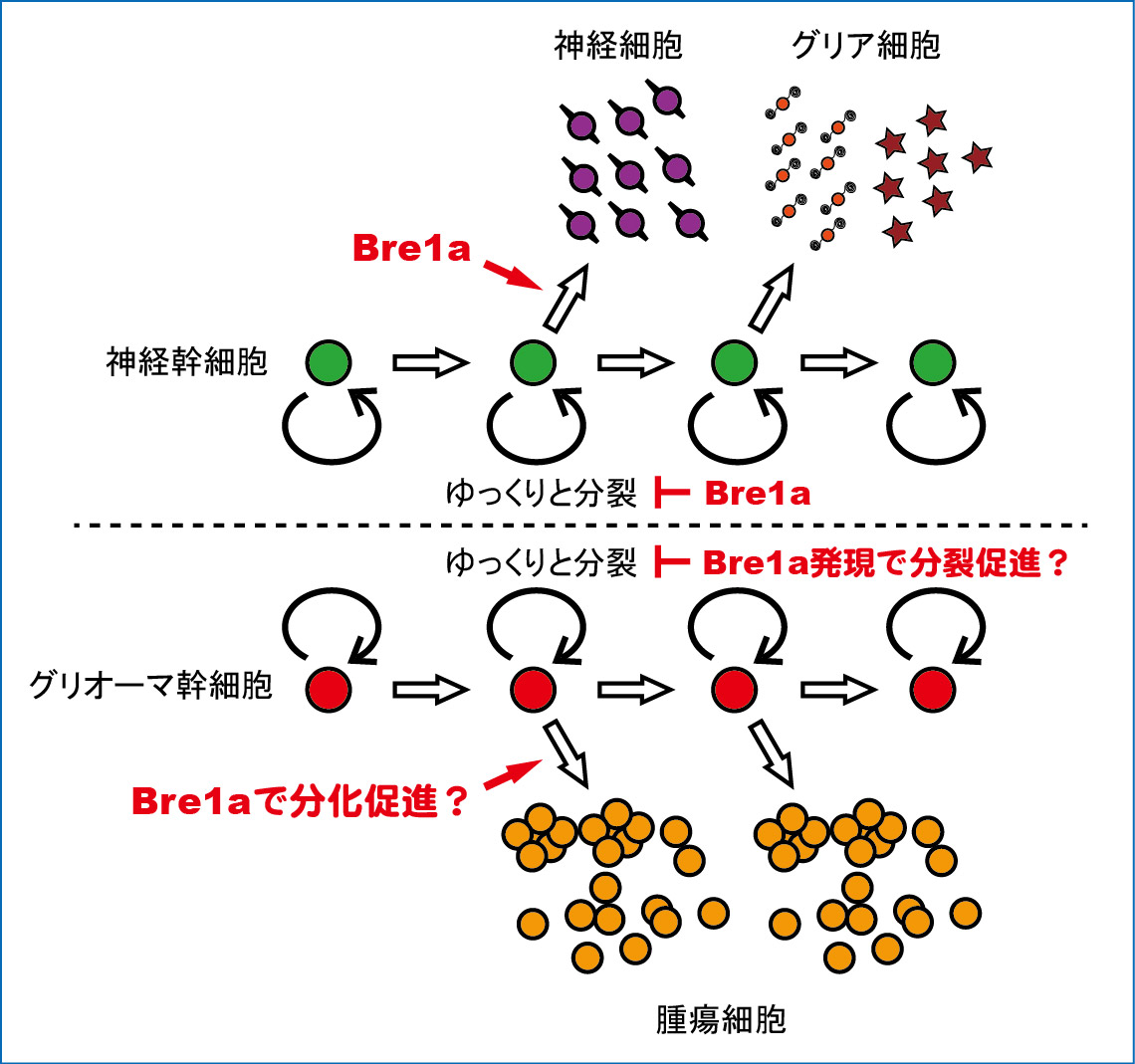
近年、激しく増殖する腫瘍
の中には、ゆっくりとしか分
裂しない”幹細胞”のような細
胞がいることが明らかになっ
ています。
ゆっくりとしか分裂しない
ので、分裂細胞をターゲット
にした放射線療法や化学療法
に抵抗性で、がんの再発に関
わっているのではないかと考
えられています。
脳腫瘍の1つであるグリオ
ーマは、神経幹細胞に近い細
胞ががん化したもので、グリ
オーマ”幹細胞”でもBre1aが
その増殖と分化を制御してい
る可能性があります(右図)。
Bre1aを標的分子とした、
脳腫瘍に対する新しい治療法
の開発が期待されます。
新聞で紹介されました
